물리적으로 암세포의 사멸을 유도, 암세포에 대한 체내 대항력을 증폭시킬 수 있는 고분자 나노버블이 소개됐다. 한국연구재단(이사장 노정혜)은 박재형 교수(성균관대학교) 연구팀이 초음파를 쬐면 기포가 나오는 나노버블로 암 세포막 파열을 유발, 네크롭토시스 유사 세포사멸을 유도했다고 밝혔다.
세포막을 붕괴시켜 스스로 사멸하는 괴사의 일종인 네크롭토시스(necroptosis)는 카스파아제 등 분해효소가 관여하는 자멸사(apoptosis)와 달리, 단백질 분해나 산화 등이 일어나지 않아 암 표지자나 면역유발물질의 손상을 최소화할 수 있다.
죽어가는 암세포를 면역반응을 활성화시킬 자극제로 이용한다면, 면역관문억제제※의 반응성을 높이는 한편 남아 있거나 전이되었을지 모를 암세포에 대한 체내 면역을 유지하는 데 유리하다. 하지만 대부분의 암에서 네크롭토시스를 유발하는 단백질(RIPK3※) 발현양이 낮아 이를 이용한 치료제 개발에 난항을 겪고 있었다.
※ 면역관문억제제 : T세포가 암세포를 공격대상으로 인지하지 못하게 하는 암세포의 면역회피신호를 억제하는 항체
※ RIPK3 : 네크롭토시스 과정에서 최종적으로 세포막 붕괴를 유도하는 단백질의 활성을 조절하는 인산화효소
이에 단백질이 아닌 물리적 자극으로 네크롭토시스를 유발하고자 하였다. 연구팀은 네크롭토시스가 세포막 파열을 수반하는 데 착안하여 기포를 이용해 암세포를 터뜨리는 고분자를 설계했다. 자가조립형 고분자에 액체 상태의 과불화펜탄을 탑재, 초음파를 쬐어주면 과불화펜탄이 기체로 변하면서 부피가 팽창, 세포막의 붕괴를 유도하는 원리다.
연구팀은 RIPK3 단백질 발현 유무와 상관없이 초음파 조사 시 나노버블에 의해 암세포의 구조가 붕괴되는 것을 공초점현미경을 통해 관찰하였다. 실제 대장암 세포에 나노버블을 처리하면 활성산소를 처리한 경우와 달리, 세포손상에 대응하는 면역유발물질(HMGB1)이 산화되지 않고 다량 방출, 면역세포인 수지상세포의 성숙도를 월등히 높이는 것을 확인했다.
나아가 폐로 암이 전이된 생쥐 모델에 면역관문억제제(PD-L1 항체)와 함께 나노버블을 병용투여한 결과 억제제 단독투여시 보다 종양의 무게가 97% 수준의 감소율을 나타내는 등 반응성이 향상되었다.
종양 내 암세포를 공격하는 면역세포(CD8+ T세포)가 월등히 늘어났고 잔존 암과 전이암의 성장이 확연히 억제되는 것을 통해 나노버블에 의한 네크롭토시스 유도가 결과적으로 면역체계 활성화를 이끌었음을 확인하였다.
과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구자, 선도연구센터)의 지원으로 수행된 이번 연구의 성과는 국제학술지 어드밴스드 머티리얼즈(Advanced Materials) 표지논문으로 3월 3일 온라인판에 게재되었다.
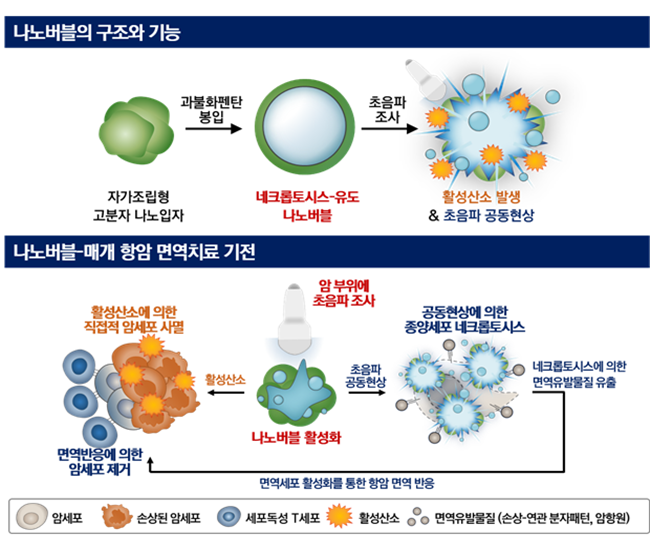
(그림1) 네크롭토시스 유도 나노버블의 구조 및 나노버블-매개 항암 면역 기전 모식도
(상) 양친성 고분자 기반 자가조립형 나노입자의 소수성 중심부에 기체전구체인 과불화펜탄을 봉입하여 네크롭토시스-유도 나노버블을 제조하였다. 초음파를 조사하면 고분자 주쇄에 접합된 음파감각제에 의해 활성산소가 발생하는 한편, 액상 과불화펜탄에 의한 초음파 공동 현상이 일어난다.
(하) 네크롭토시스-유발 나노버블을 종양 동물모델에 정맥 투여 한 후 암 부위에 초음파를 조사함으로써 활성산소에 의한 직접 세포사멸 및 초음파 공동 현상에 의한 네크롭토시스를 유발할 수 있다. 네크롭토시스가 발생한 종양 세포의 경우, 손상 없이 다량의 면역유발물질을 유출하여 효과적으로 체내 면역 반응을 촉진시킬 것으로 기대된다. (그림 제공 : 성균관대 박재형)
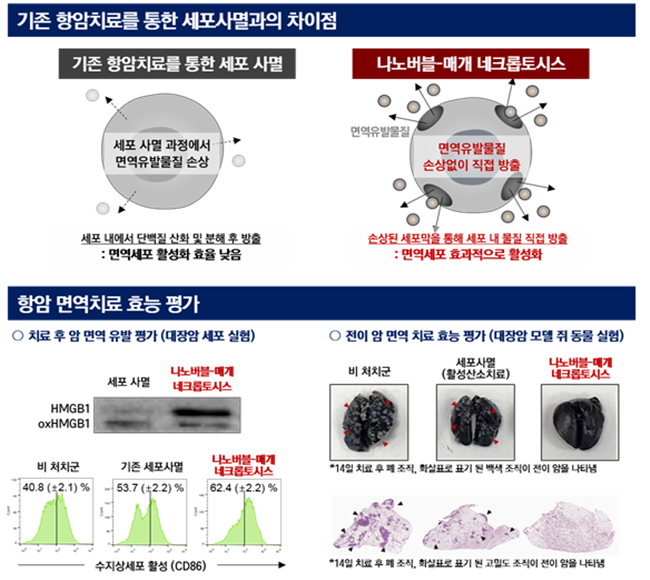
(그림2) 나노버블-매개 네크롭토시스와 기존 항암치료를 통한 세포사멸과의 차이
(상) 항암화학요법, 광/초음파 역동 치료 등 기존 항암치료를 통한 세포사멸의 경우, 카스파아제가 관여하는 세포사멸(아팝토시스)이 주로 유도된다. 이 경우, 면역유발물질들이 단백질 분해 효소 및 산화 등에 의해 손상되어 면역세포의 활성화 효율이 제한적이다. 반면, 나노버블-매개 네크롭토시스는 세포막의 파열을 유도하여 면역유발물질들이 손상 없이 다량 유출될 수 있으므로 체내의 면역세포를 효과적으로 활성화할 수 있다.
(하) 대장암 세포주를 이용한 실험결과, 활성산소치료에 의한 기존 세포사멸 과정에서 방출되는 HMGB1이 주로 산화된 형태(oxHMGB1)로 존재하는 반면, 나노버블을 처리한 경우 산화되지 않은 HMGB1 형태로 방출되는 것을 확인하였다. 또한, 각 세포사멸에 의한 수지상세포의 성숙도를 평가하기 위하여 대표적인 공동자극분자인 CD86의 발현양을 비교하였다. (좌) 최종적으로 폐 전이암 모델 쥐에 나노버블-매개 네크롭토시스를 유도한 경우, 면역관문 억제제와 병용치료 시 기존 항암치료와는 다르게 폐 조직 내 전이암 성장을 완전히 억제함을 확인하였다. (우) (그림 제공 : 성균관대 박재형)