- KAIST 신소재공학과 장재범 교수 연구팀, 기존 형광 신호 대비 9배 이상 증폭 성공
- 암 진단 및 치료기술 개발, 다지표검사, 의료 및 신약 개발 분야에 기대

▲(왼쪽부터) KAIST 신소재공학과 서준영 박사과정, 장재범 교수, 조예린 학사과정
KAIST(총장 신성철)는 신소재공학과 장재범 교수 연구팀이 암 진단에 필요한 새로운 형광 신호 증폭 기술을 개발했다고 17일 밝혔다. 연구 결과는 국제 학술지인 영국왕립화학회(Royal Society of Chemistry)의 `나노스케일(Nanoscale)'誌 11월 13일 字에 게재됐다. (논문명: FRACTAL: Signal amplification of immunofluorescence via cyclic staining of target molecules)
※ 저자 정보: 조예린(KAIST 학사과정 학생, 제1 저자), 서준영(KAIST 박사과정 학생, 제2 저자), 장재범 교수(교신저자) 등 총 8명
최근 3D 전체 조직 영상화(이미징)를 가능하게 하는 생체조직 *팽창 기술(ExM) 및 투명화 기술(CLARITY, 3DISCO, CUBIC)은 복잡한 세포 간 상호작용 및 역할을 밝혀내는 핵심적인 역할을 하고 있다. 하지만 큰 부피 내부의 세포 변화를 관찰하기 위해서는 약한 형광 신호를 증폭해 높은 이미지 처리량을 갖는 기술이 필요하다.
※ 팽창 현미경 (Expansion Microscopy): 조직을 팽창시켜 일반 현미경으로 초고해상도를 얻을 수 있는 기술
※ 조직 투명화 기술 (Tissue Clearing System): 빛의 산란을 최소화하고 투과도를 극대화하여 3D 전체 조직을 이미징하는 기술
지금까지 신호 증폭 기술은 다양한 화학 반응으로 개발돼왔는데, 이들 중 많은 기술은 단일 화학 반응을 이용하기 때문에 다중 표지 신호 증폭 영상화를 위해서는 단일 신호 증폭과 비활성화 과정을 채널별로 반복해야 하는 단점이 있고, 유전자(DNA) 기반의 신호 증폭 기법은 서로 다른 항체에 대한 유전 물질 분자 결합의 최적화 과정이 필요하므로 일반적인 생물 실험실에서 사용이 어렵다.
장재범 교수 연구팀은 이러한 문제점 개선을 위해 현재 상용화돼 있는 형광 분자가 표지된 항체를 사용해, 추가적인 최적화 과정이 필요 없는 신호 증폭 기술에 주목했다.
결과적으로 연구팀은 `프랙탈(FRACTAL, Fluorescence signal amplification via repetitive labeling of target molecules)'이라는 새로운 신호 증폭 기술을 개발했다. 프랙탈 기술은 항체 기반의 염색 방법으로, 신호 증폭 과정이 매우 간단하다는 특징이 있다. 이 기술은 신호 증폭을 위해 특수한 화학 물질을 필요로 하지 않으며, 형광 분자가 표지된 2차 항체의 반복적인 염색을 통해 형광 신호를 증폭시킨다.
이 기술은 한 종류의 1차 항체, 두 종류의 2차 항체, 총 세 종류의 항체를 이용하는 아주 간단한 기술이다. 신호 증폭 과정은 표적 단백질에 대한 1차 항체 및 첫 번째 2차 항체 염색으로 시작되며, 그다음으로 첫 번째 2차 항체에 결합하는 두 번째 2차 항체의 염색이 이뤄진다. 두 번째 2차 항체의 숙주(host)와 1차 항체의 숙주(host)는 같으며, 그다음 염색은 다시 두 번째 2차 항체에 결합하는 첫 번째 2차 항체의 염색으로 이어진다.
예를 들어 토끼의 1차 항체를 사용하고 당나귀의 항-토끼 2차 항체를 첫 번째 2차 항체로 사용했다면 토끼의 항-당나귀 2차 항체를 두 번째 2차 항체로 사용하게 된다. 그러면 두 번째 2차 항체에는 첫 번째 2차 항체가 결합하게 되고 그 반대의 경우로도 결합해 염색을 이어나가게 된다.
이 과정의 반복을 통해 연구팀은 기존 형광 신호를 9배 이상 증폭시켰으며, 이는 같은 밝기를 얻는 데 필요한 영상화 시간을 9배 이상 줄일 수 있다는 결과를 얻었다. 연구팀은 초고해상도 현미경(STORM) 분석을 통해 염색 횟수에 따라 항체가 균일한 결합 층을 형성하며 형광 신호를 증폭시키는 현상을 확인했다.
연구팀은 이 기술을 서로 다른 종으로부터 유래된 직교적인(orthogonal) 항체 쌍에 적용해, 동시 다중 표지 신호 증폭 영상화를 구현했으며, 팽창 현미경에도 적용해 팽창 후에도 높은 형광의 강도를 갖는 형광 신호 증폭 기술을 구현했다.
이 기술은 간단한 항체-항원 반응에 기반해 형광 신호를 증폭시키는 기술로, 영상을 통한 생체조직의 분석 및 치료기술 개발, 다지표 검사, 의료 및 신약 개발 분야에 이바지할 것으로 연구진은 기대하고 있다.
제1 저자인 조예린 KAIST 신소재공학과 학생은 "높은 이미지 처리량을 가진 이 기술은 디지털 병리 분야의 발전에 중추적인 영향을 미칠 것ˮ이며, "생체 내 다중지표에 대한 정보를 정밀하게 제공해 현대 의약 분야의 의약품 분석 및 치료 시스템에 직접적으로 응용될 수 있다ˮ라고 말했다.
장재범 교수도“이 기술은 환자 생체 검사 조직 내부에서 매우 중요하지만 낮은 수준으로 발현되는 바이오마커들을 정확하게 이미징 할 수 있게 해주기 때문에, 암 진단 및 면역 항암제 반응률 예측 등에 큰 도움이 될 것으로 기대된다.”라고 강조했다
한편 이번 연구는 과학기술정보통신부가 지원하는 뇌과학원천기술개발 과제와 KAIST 학부연구생프로그램(URP)의 지원을 받아 수행됐다.
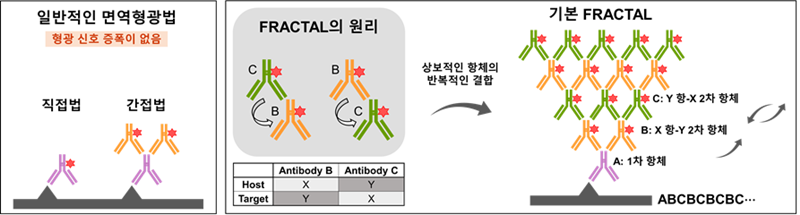
그림 1. 형광 분자가 표지 된 상보적인 항체의 반복적인 라벨링을 통한
형광 신호 증폭 기술을 보여주는 모식도
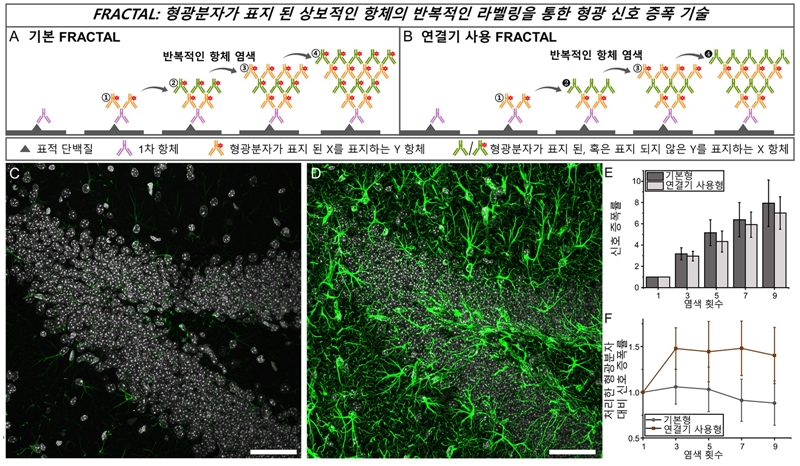
그림 2. (A) 기본 FRACTAL과 (B) 연결기 사용 FRACTAL 기술의 도식. 기본 FRACTAL을 이용하여 세포 및 쥐 뇌 절편의 형광 신호를 증폭한 결과. (C) 1회 염색한 쥐 뇌 절편의 공초점 현미경 이미지 (녹색: GFAP, 회색: DAPI). (D) 4회 염색한 쥐 뇌 절편의 공초점 현미경 이미지. (E) 염색 횟수 당 신호 증폭률. (F) 염색 횟수 당 처리한 형광 분자 대비 신호 증폭률.
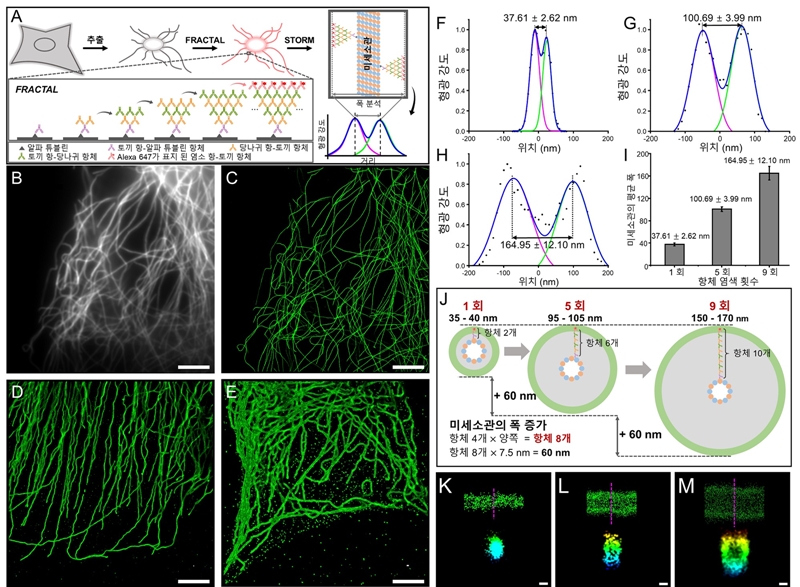
그림 3. FRACTAL을 적용한 미세소관의 3차원 미세 구조. (A) 본 기술을 미세소관 초고해상도 STORM 이미징에 적용한 원리 (C-E) 미세소관을 각각 1, 5, 9회 염색한 후, STORM으로 이미징 한 결과. 스케일 바, 5μm. (F-H) A-C의 미세소관의 지름. (I) 염색 횟수에 따른 미세소관의 지름 (J) 미세소관의 1회, 5회, 9회 염색 후 예상 구조. (K-M) A-C의 미세소관의 하향식 및 횡단면 이미지. 상단: 하향식, 하단: 횡단면, 스케일 바, 100 nm.
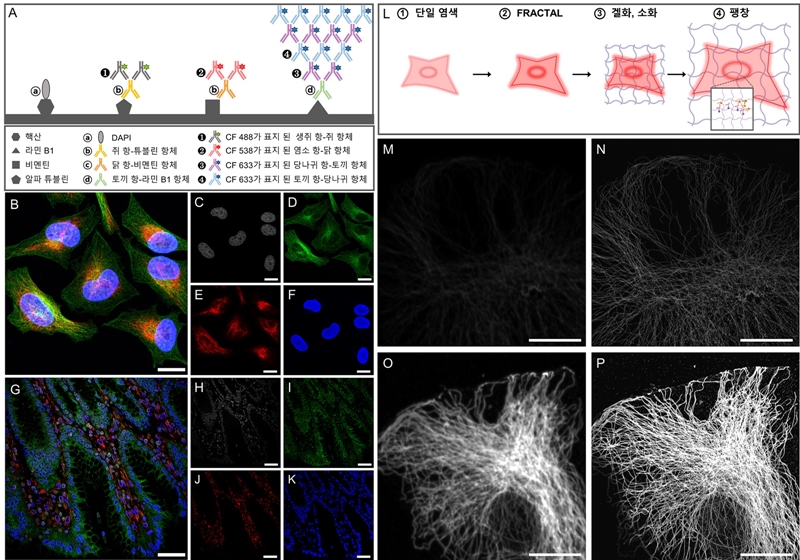
그림 4. 본 기술을 다중 표지 이미징에 적용한 결과. (A) 서로 직교적인 항체 쌍을 이용한 다중 표지 이미징에서의 신호 증폭 기술을 보여주는 모식도. (B) BS-C-1 세포 내부 4종 단백질의 이미지. (C-F) 회색: DAPI, 녹색: 알파 튜블린, 적색: 비멘틴, 청색: 라민 B1. (G) 병리학 샘플의 4종 단백질 이미지. (H-K) 회색: DAPI, 녹색: 튜블린, 빨간색: 비멘틴, 파란색: 히스톤. 스케일바, 50μm.
본 기술을 팽창 현미경에 적용한 결과. (L) 본 기술을 팽창 현미경에 적용한 원리 (M) 1회 염색한 미세소관의 이미지. (N) (M)에 팽창 현미경을 적용한 미세소관의 이미지. (O) 9회 염색한 미세소관의 이미지. (P) (O)에 팽창 현미경을 적용한 미세소관의 이미지. 스케일바, 20μm. (N)과 (P)의 팽창 계수 4.